|
|
 |
|
Bild 1: Drosera glanduligera in Kultur. a) Blüte. b) Ausgewachsene Pflanzen produzieren zahlreiche Samenkapseln an den Blütenstängeln.
c) REM-Aufnahme eines Samenkorns mit konkaven Testazellen und epikutikularen Wachskristallen. |
Analyse des Beutefangs
Obwohl sie sehr wahrscheinlich
in der Natur nicht die natürliche Beute sind, benutzten wir für unsere
Experimente zum Beutefang Fruchtfliegen (Drosophila
melanogaster), da diese im Handel leicht erhältlich und einfach zu halten
sind. Unsere Absicht war es zu untersuchen, welche Rolle Schnelltentakel beim
Beutefang spielen, d. h., ob die Tentakel tatsächlich in der Lage sind,
Beutetiere unter Laborbedingungen zu schleudern (Davion 1995; 1999). Es steht
nach wie vor aus, dieses Verhalten am Standort mit der natürlichen Beute (z. B.
Collembola, Ameisen) zu untersuchen
und die Relevanz für die Pflanze zu ermitteln. Eine ausführliche Beschreibung
der verwendeten Materialien und Methoden, sowie ein Ausblick auf weiterführende
Projekte finden sich in unserem Originalartikel (Poppinga et al. 2012).
Wir setzten Fruchtfliegen neben die Pflanzen und nahmen die Fangvorgänge mittels HDV-Kamera und einer Hochgeschwindigkeitskamera mit 2000 Bildern pro Sekunde auf. Die resultierenden Videos (Hartmeyer & Hartmeyer 2012; Poppinga et al. 2012) zeigten eindeutig, dass die schnelle Katapultfunktion der Schnelltentakel kombiniert ist mit einem langsameren „Förderband-Mechanismus“ der zentraleren Leimtentakel des Fangblatts. Zuerst wird die Beute angehoben und von den Schnelltentakeln auf das Fangblatt geworfen, wobei diese sich nach mechanischer Stimmulation durch das Beutetier innerhalb von 75 Millisekunden zum Blattzentrum biegen. Dort befindet sich die Beute in einer äußerst prekären Situation, denn bei den meisten Beutewürfen landete diese mit dem Rücken auf den Leimtentakeln und wir gehen davon aus, dass dieser Mechanismus effektiv die Beweglichkeit der Beute einschränkt. Ausgelöst durch die mechanische Energie des Aufpralls (oder auch indirekt ohne direkte Berührung) beginnen sich dann auch die Leimtentakel in Richtung auf das Blattzentrum zu biegen. Das geschieht zwar deutlich langsamer in etwa zwei Minuten, ist jedoch immer noch recht flott für eine Tentakelbewegung. Dabei wird die Beute in eine konkave Mulde, wo die Verdauung stattfindet, im Zentrum der Falle transportiert, offensichtlich auch gut geschützt vor Kleptoparasiten, die beispielsweise bei den sympatrischen Drosera erythrorhiza bekannt sind (Watson et.al. 1982). Im Gegensatz zu vielen anderen Sonnentau (Darwin 1875; Lloyd 1942: Williams 1976; Juniper et.al. 1989) konnten wir während des Beutefangs keinerlei Blattbewegung feststellen. Solch ein ausgeklügelter kombinierter zweistufiger aktiver Fangmechanismus ist im Pflanzenreich einmalig, daher prägten wir dafür den Begriff aktive Katapult-Leimfalle, die ausschließlich bei D. glanduligera anzutreffen ist.
Ein passives Katapult-Fallgruben System, ermöglicht durch eine mehr oder weniger rutschige Gleitoberfläche am Kannendeckel und ausgelöst durch die Aufprallenergie von Regentropfen, wurde kürzlich bei der Kannenpflanze Nepenthes gracilis beschrieben (Bauer et.al. 2012) und ist ein weiteres Beispiel für eine Hybrid-Fangstrategie (Rice 2007).
Wir setzten Fruchtfliegen neben die Pflanzen und nahmen die Fangvorgänge mittels HDV-Kamera und einer Hochgeschwindigkeitskamera mit 2000 Bildern pro Sekunde auf. Die resultierenden Videos (Hartmeyer & Hartmeyer 2012; Poppinga et al. 2012) zeigten eindeutig, dass die schnelle Katapultfunktion der Schnelltentakel kombiniert ist mit einem langsameren „Förderband-Mechanismus“ der zentraleren Leimtentakel des Fangblatts. Zuerst wird die Beute angehoben und von den Schnelltentakeln auf das Fangblatt geworfen, wobei diese sich nach mechanischer Stimmulation durch das Beutetier innerhalb von 75 Millisekunden zum Blattzentrum biegen. Dort befindet sich die Beute in einer äußerst prekären Situation, denn bei den meisten Beutewürfen landete diese mit dem Rücken auf den Leimtentakeln und wir gehen davon aus, dass dieser Mechanismus effektiv die Beweglichkeit der Beute einschränkt. Ausgelöst durch die mechanische Energie des Aufpralls (oder auch indirekt ohne direkte Berührung) beginnen sich dann auch die Leimtentakel in Richtung auf das Blattzentrum zu biegen. Das geschieht zwar deutlich langsamer in etwa zwei Minuten, ist jedoch immer noch recht flott für eine Tentakelbewegung. Dabei wird die Beute in eine konkave Mulde, wo die Verdauung stattfindet, im Zentrum der Falle transportiert, offensichtlich auch gut geschützt vor Kleptoparasiten, die beispielsweise bei den sympatrischen Drosera erythrorhiza bekannt sind (Watson et.al. 1982). Im Gegensatz zu vielen anderen Sonnentau (Darwin 1875; Lloyd 1942: Williams 1976; Juniper et.al. 1989) konnten wir während des Beutefangs keinerlei Blattbewegung feststellen. Solch ein ausgeklügelter kombinierter zweistufiger aktiver Fangmechanismus ist im Pflanzenreich einmalig, daher prägten wir dafür den Begriff aktive Katapult-Leimfalle, die ausschließlich bei D. glanduligera anzutreffen ist.
Ein passives Katapult-Fallgruben System, ermöglicht durch eine mehr oder weniger rutschige Gleitoberfläche am Kannendeckel und ausgelöst durch die Aufprallenergie von Regentropfen, wurde kürzlich bei der Kannenpflanze Nepenthes gracilis beschrieben (Bauer et.al. 2012) und ist ein weiteres Beispiel für eine Hybrid-Fangstrategie (Rice 2007).
 |
| Ankunft von Testpflanzen aus Weil am
Rhein bei der Plant Biomechanics Group des Botanischen Gartens der
Universität Freiburg. Simon Poppinga (rechts) war dort für die Entwicklung und Durchführung der Experimente verantwortlich. |
Wie können sich
Schnelltentakel so schnell biegen? Aktive Bewegungen wie das Einfalten der
Blätter bei Mimosa pudica werden oft
durch eine Änderung des Zelldrucks (Zellsaftdruck) in antagonistisch wirkenden (gegensätzlich
„arbeitenden“) Zellgeweben ermöglicht, sogenannten Pulvini (Braam 2005). Solche
Systeme basieren auf der Verschiebung von Flüssigkeit durch ein poröses Medium,
das Pulvinusgewebe, und werden daher hydraulisch angetrieben. Die Dauer der
Flüssigkeitsverschiebung und damit die Dauer der Bewegung hängt ab von der
Dicke des Gewebes, welches die Flüssigkeit durchströmt. Für eine schnelle
Bewegung muss das Organ daher klein sein (wie der hydraulisch bewegte Mimosa-Pulvinus) (Volkov et.al. 2010), oder es muss über einen
einfachen aber effektiven Trick verfügen: Elastische Energie kann durch
spezielle strukturelle Anpassungen wie in einem Bogen gespeichert und bei
Bedarf zur Ausführung einer extrem schnellen Bewegung abgegeben werden (Skotheim
& Mahadevan 2005; Dumais & Forterre 2012). Die Venus Fliegenfalle
beispielsweise besitzt große und schnelle Fallen (das Zuklappen dauert ~100 ms),
deren Schnelligkeit auf spontaner Krümmungsinversion der Fallenhälften beruht,
vergleichbar mit dem Kinderspielzeug „Gummi-Popper“ oder „Plopp-Scheibe“ (englisch:
rubber-popper-toy). Hier wird eine elastische Halbschale „auf links“ gedreht,
und durch spontanes Zurückschnappen dieser Fläche von konkav nach konvex
katapultiert sie sich in die Höhe. Ein weiteres Beispiel ist der
Wasserschlauch. Obwohl die Fallentür sehr klein ist, bewegt sie sich bei ihren
ultraschnellen Bewegungen unterhalb einer Millisekunde zu schnell auf, um rein
hydraulisch angetrieben zu sein (Vincent et
al. 2011). Die schnellsten Bewegungen werden von Pflanzen durch nicht
reversible Explosionsmechanismen erzeugt, wie z. B. bei den berstenden
Früchten des Sandbüchsenbaums (Hura
crepitans) (Swaine & Beer 1977).
Als wir die schnelle Biegung der Schnelltentakel zum ersten Mal zeitlich voll aufgelöst sahen, glaubten wir auch, dass eine elastische Vorspannung beteiligt ist. Da hier eine lange dünne Struktur eine Biegung in sehr kurzer Zeit ausführt (75 ms), vermuteten wir genaugenommen einen ähnlichen Mechanismus wie bei speziellen Fahrrad-Reflektorbändern. Diese bestehen aus in ihrer Querachse vorgekrümmten Bändern, die nach einem Schlag auf z. B. das Handgelenk, diese Krümmung spontan umkehren und sich aufgrund ihrer intrinsischen mechanischen Eigenschaften zusammenrollen (bzw. um das Handgelenk rollen). Überraschenderweise fanden wir heraus, dass die Querachse des Tentakels keinerlei plötzliche Änderung der Geometrie zeigt, und außerdem existieren keine auffälligen anatomischen Merkmale, die in der Lage wären elastische Energie zu speichern (z. B. verdickte Zellwände) (siehe auch „Morphologie und Anatomie der Tentakel“).
Wie in unserem Originalartikel (Poppinga et al. 2012) beschrieben, lässt sich berechnen, dass die Schnelltentakel theoretisch klein genug sind, um tatsächlich rein hydraulisch angetrieben zu werden und sich hierdurch so schnell zu biegen. Daher deuten wir die schnelle Bewegung als eine Änderung des Zelldrucks (Turgor) in antagonistischen Gewebeschichten. Jedoch sind weitere Experimente, besonders physiologischer Natur, nötig für eine gründliche Überprüfung. Die Schnelltentakel von D. glanduligera funktionieren nur einmal, wahrscheinlich, weil während der schnellen Bewegung viele Epidemiszellen platzen, was sie von den Schnelltentakeln ohne Gelenkzone bei anderen Sonnentau wie etwa D. burmannii deutlich unterscheidet, die alle mehrfach funktionieren.
Als wir die schnelle Biegung der Schnelltentakel zum ersten Mal zeitlich voll aufgelöst sahen, glaubten wir auch, dass eine elastische Vorspannung beteiligt ist. Da hier eine lange dünne Struktur eine Biegung in sehr kurzer Zeit ausführt (75 ms), vermuteten wir genaugenommen einen ähnlichen Mechanismus wie bei speziellen Fahrrad-Reflektorbändern. Diese bestehen aus in ihrer Querachse vorgekrümmten Bändern, die nach einem Schlag auf z. B. das Handgelenk, diese Krümmung spontan umkehren und sich aufgrund ihrer intrinsischen mechanischen Eigenschaften zusammenrollen (bzw. um das Handgelenk rollen). Überraschenderweise fanden wir heraus, dass die Querachse des Tentakels keinerlei plötzliche Änderung der Geometrie zeigt, und außerdem existieren keine auffälligen anatomischen Merkmale, die in der Lage wären elastische Energie zu speichern (z. B. verdickte Zellwände) (siehe auch „Morphologie und Anatomie der Tentakel“).
Wie in unserem Originalartikel (Poppinga et al. 2012) beschrieben, lässt sich berechnen, dass die Schnelltentakel theoretisch klein genug sind, um tatsächlich rein hydraulisch angetrieben zu werden und sich hierdurch so schnell zu biegen. Daher deuten wir die schnelle Bewegung als eine Änderung des Zelldrucks (Turgor) in antagonistischen Gewebeschichten. Jedoch sind weitere Experimente, besonders physiologischer Natur, nötig für eine gründliche Überprüfung. Die Schnelltentakel von D. glanduligera funktionieren nur einmal, wahrscheinlich, weil während der schnellen Bewegung viele Epidemiszellen platzen, was sie von den Schnelltentakeln ohne Gelenkzone bei anderen Sonnentau wie etwa D. burmannii deutlich unterscheidet, die alle mehrfach funktionieren.
 |
| Simon Poppinga (links) und Siggi Hartmeyer bei der Analyse einzelner abgetrennter Schnelltentakel mittels Hochgeschwindigkeitskamera. |
Morphologie und Anatomie der Tentakel
Die löffelförmigen
Fangblätter von D. glanduligera
besitzen eine Vielzahl an Leimtentakeln und bei vollständig entwickelten
Katapult-Leimfallen etwa 12-18 katapultierende Schnelltentakel, die horizontal
in der Blattebene entspringen. Die mechanische Stimulation der Köpfe beider
Tentakeltypen verursacht die oben beschriebene Biegungsbewegung. Die
Leimtentakel zeigen einen Bauplan, der typisch für Droseratentakel ist, die
fast vertikal aus der Blattspreite wachsen und mehr oder weniger runde, Schleim
produzierende Köpfe besitzen. Der Verbindungsbereich zwischen Kopf und
Tentakelstiel gilt an der dünnsten Stelle allgemein als mechanischer
Rezeptorbereich (Williams 1976). Obwohl wir die Bewegung der Leimtentakel
aufzeichneten, haben wir deren Anatomie nicht im Detail untersucht.
 |
 |
| Aufnahmen mit dem Rasterelektronenmikroskop (REM) | Probenkammer des Rasterelektronenmikroskops |
Abgetrennte
Schnelltentakel analysierten wir mittels Lichtmikroskop und
Rasterelektronenmikroskop. Fünf μm semidünne, mit Toluidinblau gefärbte Quer-
und Längsschnitte wurden mittels Lichtmikroskop untersucht. Die technischen
Details und Methoden können in unserem Originalartikel (Poppinga et al. 2012) nachgelesen werden. Wie
bereits von Seine & Barthlott (1993) aufgezeigt, sind die Schnelltentakel
bilateral symmetrisch. Der Stiel ist abgeflacht mit einer sogenannten
Endscheibe (englisch: terminal disc) versehen, die an eine menschliche Hand
erinnert, welche den schleimfreien Kopf hält (Bild 2). Der abgeflachte Stiel
mit seiner breiten Basis bedingt wahrscheinlich die in einer Ebene
stattfindende kreisförmige Biegungsbewegung des Schnelltentakels in Richtung
der Blattfalle, wohingegen sich die zylindrischen Leimtentakel in alle
Richtungen biegen können. Die Kopf-Stiel-Verbindung der Schnelltentakel ist
ausgesprochen dünn und spielt höchstwahrscheinlich eine wichtige Rolle bei der
Wahrnehmung mechanischer Reize (Bild 2).
 |
|
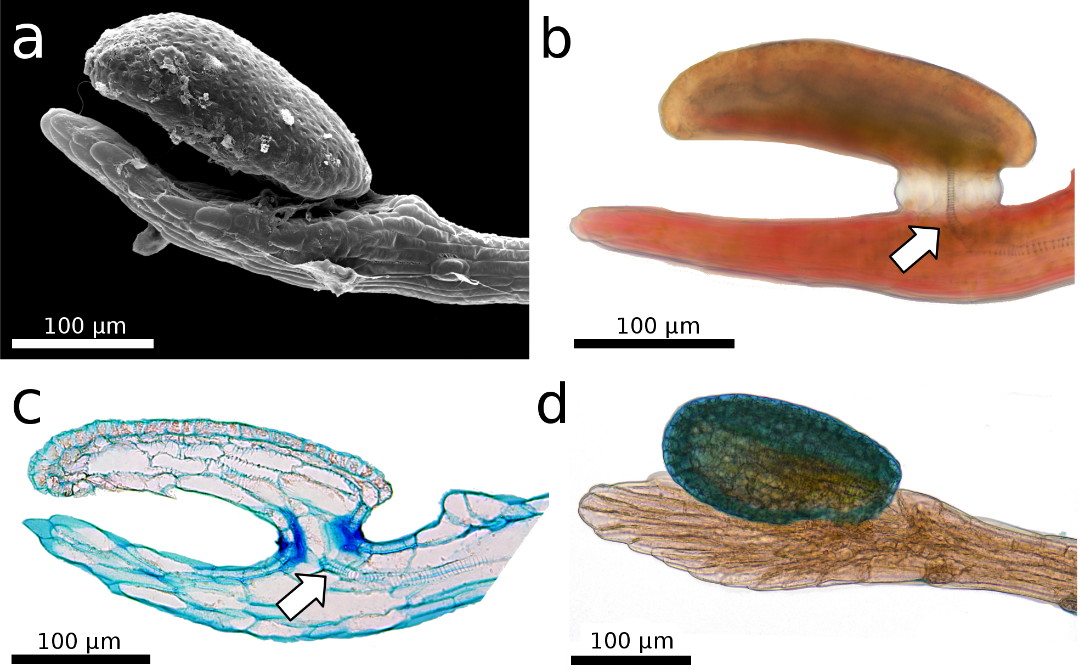
Bild 2:
Der Schnelltentakelkopf ist über der sogenannten Endscheibe am
Stielende angehoben, was Ähnlichkeit mit einer menschlichen Hand hat. a) REM-Aufnahme. b,c,d) Lichtmikroskopische Aufnahme. b,c) Das Leitbündel ist gut sichtbar (Pfeile). c)
5 µm
semidünner Längsschnitt, gefärbt mit Toluidinblau. Die dünne
Stiel-Kopf-Verbindung spielt höchstwahrscheinlich eine wichtige Rolle
bei der Wahrnehmung mechanischer Reize. d) Der Tentakelkopf, gefärbt mit Toluidinblau.
|
Seitlich sind am Stiel
kleine aufsitzende Drüsen sichtbar, deren Funktion bisher unbekannt ist (Bild 3a,b).
Der Schnelltentakelstiel besteht aus äußeren Epidemiszellen, inneren
Parenchymzellen (Bild 3c) und einem Gefäßsystem (Leitbündel). Letzteres besteht
aus einem verzweigten Tracheidsystem (Bild 4a) im Tentakelkopf (siehe auch Williams
& Pickard 1974; Williams 1976), das mit einem einzelnen Leitbündel im
Zentrum des Stiels verbunden ist (Bild 2b,c). Epidermis- und Parenchymzellen
sind länglich, besitzen unterschiedliche Durchmesser und zeigen keine auffällig
verdickten Zellwände, wie bereits im Abschnitt „Analyse der Tentakelbewegung“
beschrieben (Bild 3c).
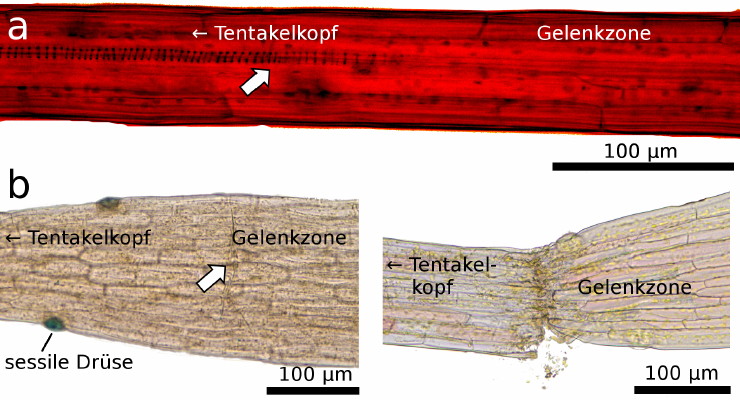
Unseren Beobachtungen zufolge ist das Leitbündel des Schnelltentakelstiels von der Blattlamina getrennt, indem es kurz vor der Gelenkzone endet (Bild 4a). Diese befindet sich nahe der Tentakelbasis und stellt den Bereich dar, in dem sich die Schnelltentakel biegen (Hartmeyer & Hartmeyer 2010; Poppinga et al. 2012). Interessanterweise befindet sich hier auch eine Lage von Zellen die wie “angeschnitten“ wirken (Bild 4b). Erfolgt seitlich ein leichter mechanischer Druck, bricht der obere Teil des Tentakels in diesem Bereich ab (Bild 4b). Obwohl die Biegung des Schnelltentakels extrem schnell ist und hierbei höchstwahrscheinlich verhältnismäßig hohe Kräfte auf das Zellgewebe wirken, existiert in diesem Bereich aber gleichzeitig auch eine mechanische Schwachstelle (oder Sollbruchstelle). Man kann wohl davon ausgehen, dass das Leitbündel den oberen Teil des Tentakels mechanisch versteift, der ja während der Bewegung gestreckt bleibt (sich also nicht krümmt). Andererseits würde so ein Leitbündel wohl die schnelle Biegung der Gelenkzone hemmen oder gar verhindern, weshalb es vermutlich während der Tentakel-Metamorphose „abgetrennt“ wird (siehe unten). Eine detailierte Untersuchung des isolierten Tracheidensystems und der Sollbruchstelle ist mit Sicherheit ein spannendes Thema für zukünftige Studien.
Unseren Beobachtungen zufolge ist das Leitbündel des Schnelltentakelstiels von der Blattlamina getrennt, indem es kurz vor der Gelenkzone endet (Bild 4a). Diese befindet sich nahe der Tentakelbasis und stellt den Bereich dar, in dem sich die Schnelltentakel biegen (Hartmeyer & Hartmeyer 2010; Poppinga et al. 2012). Interessanterweise befindet sich hier auch eine Lage von Zellen die wie “angeschnitten“ wirken (Bild 4b). Erfolgt seitlich ein leichter mechanischer Druck, bricht der obere Teil des Tentakels in diesem Bereich ab (Bild 4b). Obwohl die Biegung des Schnelltentakels extrem schnell ist und hierbei höchstwahrscheinlich verhältnismäßig hohe Kräfte auf das Zellgewebe wirken, existiert in diesem Bereich aber gleichzeitig auch eine mechanische Schwachstelle (oder Sollbruchstelle). Man kann wohl davon ausgehen, dass das Leitbündel den oberen Teil des Tentakels mechanisch versteift, der ja während der Bewegung gestreckt bleibt (sich also nicht krümmt). Andererseits würde so ein Leitbündel wohl die schnelle Biegung der Gelenkzone hemmen oder gar verhindern, weshalb es vermutlich während der Tentakel-Metamorphose „abgetrennt“ wird (siehe unten). Eine detailierte Untersuchung des isolierten Tracheidensystems und der Sollbruchstelle ist mit Sicherheit ein spannendes Thema für zukünftige Studien.
Die morphologischen
Charakteristika der Fangblätter und ihrer Tentakel während unterschiedlicher
ontogenetischer Phasen wurden vom Sämling bis zur adulten Pflanze mit einem
ProScope HR USB-Mikroskop (Bodelin Technologies, Oregon, USA) mit einer
200-fach vergrößernden Linse beobachtet. „Moderne“ Sonnentau mit
Schnelltentakeln produzieren typischerweise zwei Kotyledonen (Keimblätter), die
nur selten karnivor sind, wie z. B. bei D. ultramafica oder D.
sessilifolia, wo darauf einige Leimtentakel erscheinen (pers. Beobachtung).
Zusätzlich zu den typischen Leimtentakeln auf der Lamina bilden alle diese
Arten auf den ersten Fallenblättern drei bis fünf verlängerte, schleimfreie,
bilateral symmetrische Schnelltentakel, die horizontal in der Blattebene
entspringen. Demzufolge besitzen alle ihre Sämlinge von Beginn an voll
entwickelte Schnelltentakel, die in der Lage sind, sich höchstwahrscheinlich
durch Turgordruckänderung zu biegen. Dies geschieht in einem Bereich von
ungefähr fünf Sekunden bis zu einigen Minuten, abhängig von Art und
Umgebungstemperatur. Das Auftreten unterschiedlicher Schnelltentakel in der
Gattung Drosera wurde während des
letzten Jahrzehnts an mehr als 100 verschiedenen Arten untersucht (Hartmeyer
& Hartmeyer 2010).
Die Samen von D. glanduligera keimen ohne morphologisch anders gestaltete Keimblätter; das erste Blatt ist gleich eine voll funktionsfähige Leimfalle und wächst senkrecht aus dem Samen hervor, jedoch ohne jegliche Schnelltentakel. Die folgenden drei bis vier Blattgenerationen zeigen verschiedene Zwischenstadien, in denen die verlängerten Marginaltentakel ihre Morphologie signifikant verändern. Der anfangs mehr oder weniger runde (symmetrische) Schleim produzierende Kopf wird zunehmend ersetzt durch den typischen schleimfreien bilateral symmetrischen gehobenen Kopf, wie oben beschrieben. Während die Gelenkzone des Stiels sich mehr und mehr ausbildet, wird das anfangs durchgehende Leitbündel (Bild 5) während der Übergangsphasen direkt an der Gelenkzone von der Lamina abgetrennt (Bild 4). Auch die Verdauungsmulde im Zentrum des Blattes prägt sich immer deutlicher aus. In Kultur erschienen die ersten voll funktionsfähigen Katapult-Leimfallen etwa sechs Wochen nach der Keimung. Obwohl diese ersten Schnelltentakel noch recht filigran erscheinen, sind sie dennoch in der Lage, Springschwänze in das Blattzentrum zu schleudern (pers. Beobachtung).
Die Samen von D. glanduligera keimen ohne morphologisch anders gestaltete Keimblätter; das erste Blatt ist gleich eine voll funktionsfähige Leimfalle und wächst senkrecht aus dem Samen hervor, jedoch ohne jegliche Schnelltentakel. Die folgenden drei bis vier Blattgenerationen zeigen verschiedene Zwischenstadien, in denen die verlängerten Marginaltentakel ihre Morphologie signifikant verändern. Der anfangs mehr oder weniger runde (symmetrische) Schleim produzierende Kopf wird zunehmend ersetzt durch den typischen schleimfreien bilateral symmetrischen gehobenen Kopf, wie oben beschrieben. Während die Gelenkzone des Stiels sich mehr und mehr ausbildet, wird das anfangs durchgehende Leitbündel (Bild 5) während der Übergangsphasen direkt an der Gelenkzone von der Lamina abgetrennt (Bild 4). Auch die Verdauungsmulde im Zentrum des Blattes prägt sich immer deutlicher aus. In Kultur erschienen die ersten voll funktionsfähigen Katapult-Leimfallen etwa sechs Wochen nach der Keimung. Obwohl diese ersten Schnelltentakel noch recht filigran erscheinen, sind sie dennoch in der Lage, Springschwänze in das Blattzentrum zu schleudern (pers. Beobachtung).
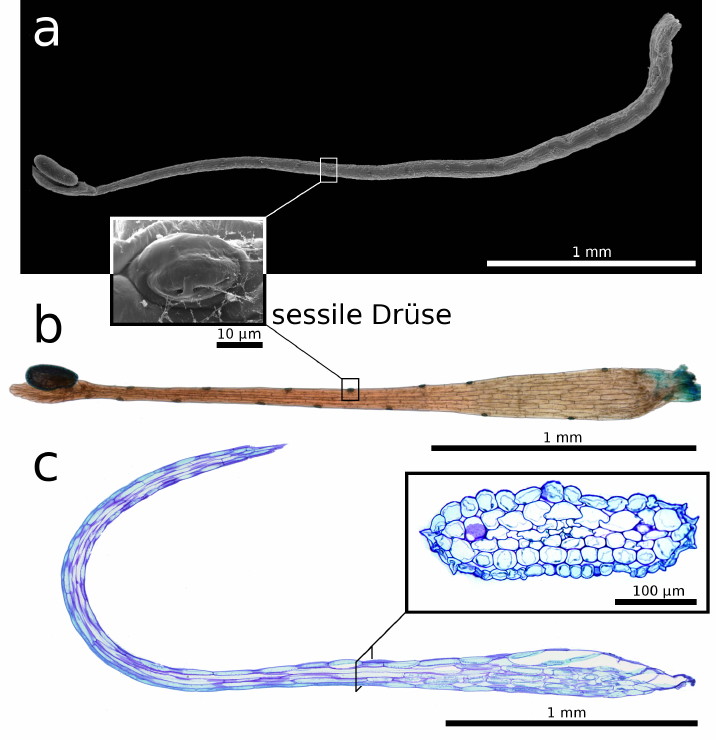 |
| Bild 3: Morphologie und Anatomie der Schnelltentakel. a) Rem-Aufnahme. b) Lichtmikroskopische Aufnahme. a, b) Aufsitzende Drüsen auf dem Stiel c) 5 µm semidünner Längsschnitt, die Einlage zeigt einen Querschnitt des Schnelltentakelstiels, beide Präparate wurden mit Toluidinblau gefärbt. |
 |
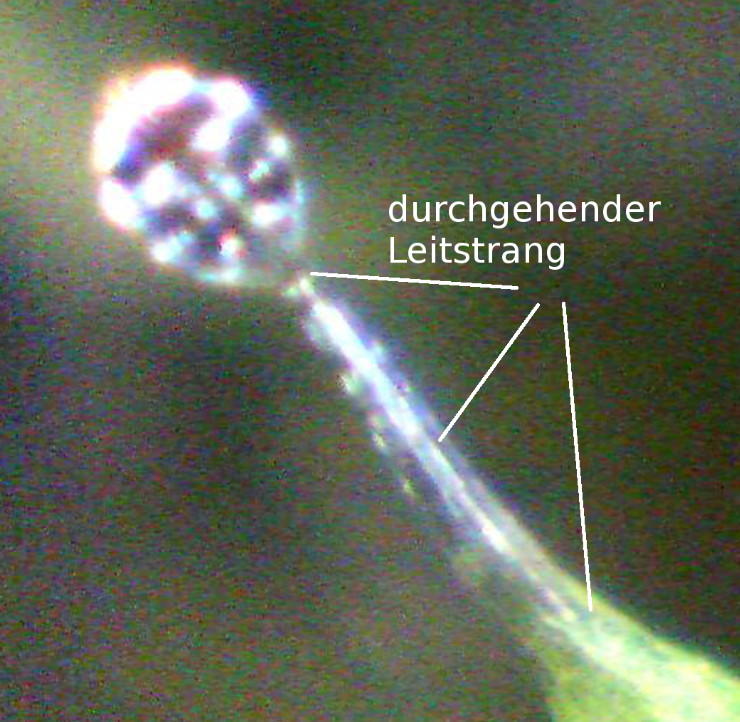 |
| Bild 4: Lichtmikroskopische Aufnahme der Übergangszone nahe der Gelenkregion, erkennbar an a) einem unterbrochenen Leitbündel (Pfeil, um die Strukturen besser hervorzuheben wurden Helligkeit und Kontrast nachjustiert) und b) durch eine mechanische Schwachstelle mit einer Zellschicht, die wie eine Sollbruchstelle erscheint (Pfeil) und bewirkt, dass der Tentakel dort bei seitlichem Druck abreisst. | Bild 5: Digital vergrößerte USB-Mikroskop Aufnahme eines marginalen Leimtentakels im frühen Entwicklungsstadium mit einem durchgehenden Leitbündel. Später werden diese durch katapultierende Schnelltentakel ersetzt, deren Leitbündel unterbrochen ist (siehe Bild 4). |
Diskussion
Ein vom Stiel angehobener
Tentakelkopf, der am Boden aufliegend die Beute von unten erfasst, ein vom
Blatt abgetrenntes Leitbündel und eine vorgeformte Tentakelbruchstelle, eine
einzigartige Gelenkzone, welche Fanggeschwindigkeiten ermöglicht wie sie bei
Aldrovanda und Dionaea (Ashida 1934; Forterre et al. 2005; Poppinga &
Joyeux 2011) auftreten – diese auffälligen Charakteristika unterscheiden die
katapultierenden Schnelltentakel von D.
glanduligera deutlich von anderen (viel langsameren) Schnelltentakeln der
übrigen Arten, wie beispielsweise D.
burmannii (Hartmeyer & Hartmeyer 2010) oder D. rotundifolia (Darwin 1875).
Die Katapult-Leimfalle setzt sich zusammen aus einer Kombination von 12-18 jeweils nur einmal funktionierenden Katapulten am Blattrand und einem nachgeschalteten „Förderband“ aus Leimtentakeln. Letztere können sowohl größere Beute zum Blattzentrum transportieren, als auch nach deren Absetzen wieder in ihre Ausgangsposition zurückkehren, um dort auf das nächste Opfer zu warten, das von einem der Katapulte hochgeschleudert wurde. Wir gehen davon aus, dass die Katapultfunktion den erfolgreichen Fang auch größerer Beutetiere ermöglicht, da diese durch die häufige Rückenlage beim Auftreffen im Blattzentrum mit den Beinen nach oben eine für sie äußerst ungünstige Position innehaben, wo sich gleichartige Beute bei einfachen Leimfallen oft noch befreien könnte.
Vermutlich werden größere Tiere seltener eingefangen, während kleinere Tiere wie Springschwänze oder Milben besonders bei jüngeren Pflanzen wohl die Hauptbeute darstellen (siehe auch „Die Kultur von D. glanduligera“). Collembola sind fast überall verbreitet und finden in verrottenden Blättern ideale Bedingungen (Fjellberg 1998), was sicher auch für die von Watson et al. (1982) als Beute bekannte Art Hypogastrura vernalis gilt. Zusätzlich wird berichtet, dass Collembola auch in großer Anzahl von anderen sympatrisch wachsenden Droseraarten gefangen werden (Watson et al. 1982; Verbeek & Boasson 1993). Diese Mikroarthropoden könnten durchaus von flüchtigen Bestandteilen angelockt werden, die von verrottendem Laub ausgehen, und wir vermuten, dass dies nicht nur bei D. glanduligera der Fall ist, wo ständig die ältesten Fangblätter im inneren Bereich der schnell wachsenden Rosette vertrocknen, sondern auch bei vielen anderen karnivoren Pflanzen. Besonders bei mehrjährigen Bodenrosetten könnte die Anhäufung von abgestorbenen Fangblättern im unteren Bereich eine attraktive Anlockzone für Beute sein. Der „Pimpernel Sundew“ hat seine Fallen jedenfalls durch die weit ausladenden und katapultierenden Tentakel auf einmalige Weise für solche Beute in der Peripherie der Pflanze perfektioniert.
Eine weitere Frage stellt sich noch hinsichtlich der Funktion der aufsitzenden Drüsen am Rand des Tentakelstiels (Bild 3a,b; 4b). Möglicherweise spielen diese eine weitere Rolle beim Beutefang, etwa durch die Abgabe von Geruchsstoffen. Es ist bekannt, dass Moose durch Geruchsstoffe selektiv und geschlechtsspezifisch Mikroarthropoden anlocken, um diese als Verbreitungsvektoren von Spermazellen zu nutzen (Rosenstiel et al. 2012). Dieser Vorgang zeigt auf, wie Collembola und andere Arthropoden chemisch angelockt werden können. Vielleicht entwickelten sich solche Mechanismen bei verschiedenen Pflanzengruppen unabhängig voneinander und aus unterschiedlichen Gründen viel häufiger als bisher gedacht?
Die Katapult-Leimfalle setzt sich zusammen aus einer Kombination von 12-18 jeweils nur einmal funktionierenden Katapulten am Blattrand und einem nachgeschalteten „Förderband“ aus Leimtentakeln. Letztere können sowohl größere Beute zum Blattzentrum transportieren, als auch nach deren Absetzen wieder in ihre Ausgangsposition zurückkehren, um dort auf das nächste Opfer zu warten, das von einem der Katapulte hochgeschleudert wurde. Wir gehen davon aus, dass die Katapultfunktion den erfolgreichen Fang auch größerer Beutetiere ermöglicht, da diese durch die häufige Rückenlage beim Auftreffen im Blattzentrum mit den Beinen nach oben eine für sie äußerst ungünstige Position innehaben, wo sich gleichartige Beute bei einfachen Leimfallen oft noch befreien könnte.
Vermutlich werden größere Tiere seltener eingefangen, während kleinere Tiere wie Springschwänze oder Milben besonders bei jüngeren Pflanzen wohl die Hauptbeute darstellen (siehe auch „Die Kultur von D. glanduligera“). Collembola sind fast überall verbreitet und finden in verrottenden Blättern ideale Bedingungen (Fjellberg 1998), was sicher auch für die von Watson et al. (1982) als Beute bekannte Art Hypogastrura vernalis gilt. Zusätzlich wird berichtet, dass Collembola auch in großer Anzahl von anderen sympatrisch wachsenden Droseraarten gefangen werden (Watson et al. 1982; Verbeek & Boasson 1993). Diese Mikroarthropoden könnten durchaus von flüchtigen Bestandteilen angelockt werden, die von verrottendem Laub ausgehen, und wir vermuten, dass dies nicht nur bei D. glanduligera der Fall ist, wo ständig die ältesten Fangblätter im inneren Bereich der schnell wachsenden Rosette vertrocknen, sondern auch bei vielen anderen karnivoren Pflanzen. Besonders bei mehrjährigen Bodenrosetten könnte die Anhäufung von abgestorbenen Fangblättern im unteren Bereich eine attraktive Anlockzone für Beute sein. Der „Pimpernel Sundew“ hat seine Fallen jedenfalls durch die weit ausladenden und katapultierenden Tentakel auf einmalige Weise für solche Beute in der Peripherie der Pflanze perfektioniert.
Eine weitere Frage stellt sich noch hinsichtlich der Funktion der aufsitzenden Drüsen am Rand des Tentakelstiels (Bild 3a,b; 4b). Möglicherweise spielen diese eine weitere Rolle beim Beutefang, etwa durch die Abgabe von Geruchsstoffen. Es ist bekannt, dass Moose durch Geruchsstoffe selektiv und geschlechtsspezifisch Mikroarthropoden anlocken, um diese als Verbreitungsvektoren von Spermazellen zu nutzen (Rosenstiel et al. 2012). Dieser Vorgang zeigt auf, wie Collembola und andere Arthropoden chemisch angelockt werden können. Vielleicht entwickelten sich solche Mechanismen bei verschiedenen Pflanzengruppen unabhängig voneinander und aus unterschiedlichen Gründen viel häufiger als bisher gedacht?
 |
 |
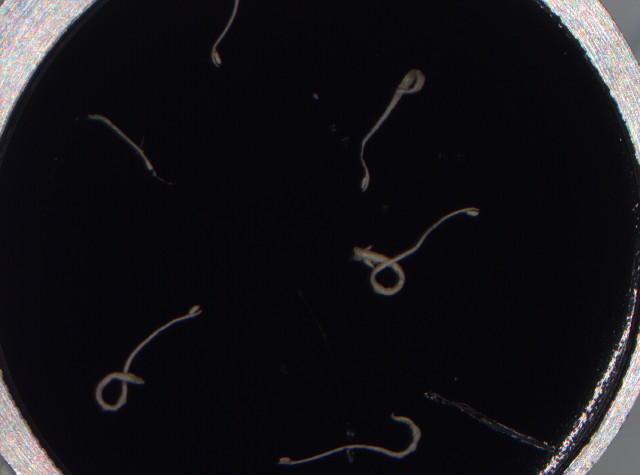
| Springschwänze (Collembola) in Blumenuntersetzer | Die Katapult-Leimfalle von D. glanduligera |
Bildquelle der REM-Aufnahmen: Poppinga et al. 2012)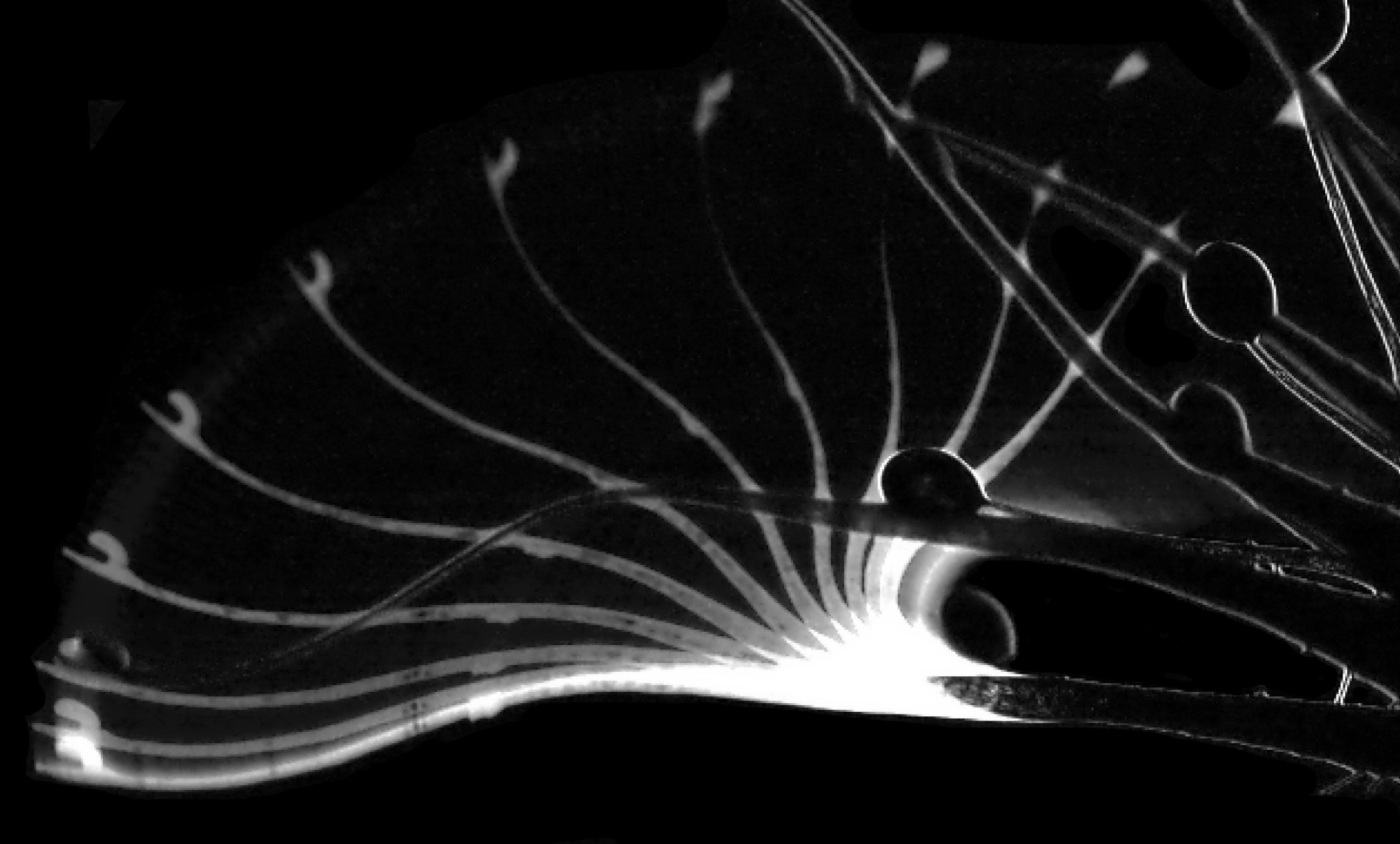 |
 |
| Aufnahmen der Katapultbahn für die Analyse der Kinematik | Kritisch-Punkt-getrocknete Präparate kurz vor dem Gold-Bedampfen |
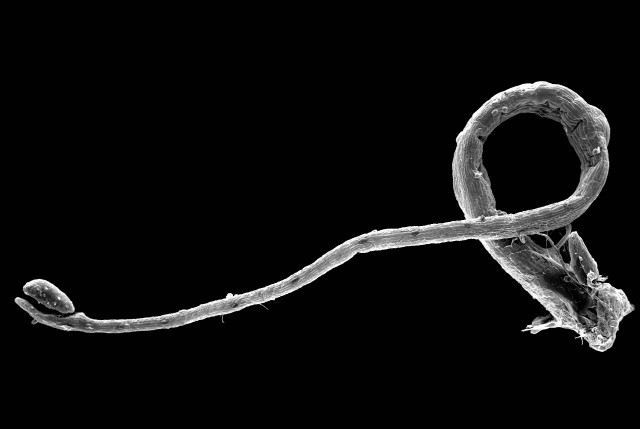 |
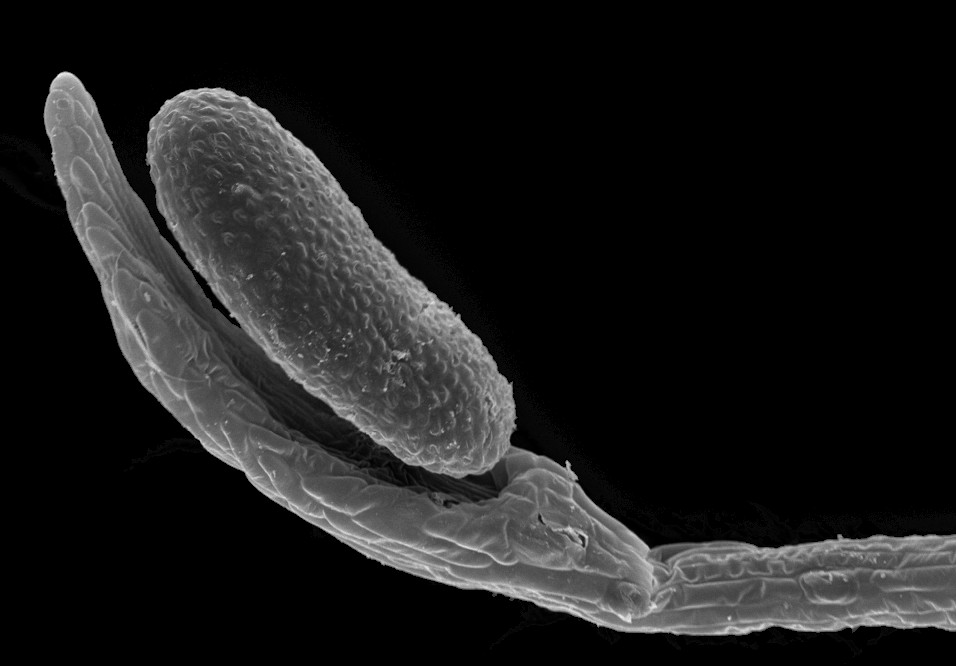 |
| REM-Aufnahme des um etwa 360° bewegten Schnelltentakels. Normalerweise wird die Bewegung nach etwa 180° durch die Blattoberfläche gestoppt. | REM-Aufnahme des berührungsempfindlichen Tentakelkopfes. |
Dokumentation der Experimente
Die oben angeführten
Experimente in den Laboren der Plant Biomechanics Group des Botanischen Gartens
der Albert-Ludwigs-Universität Freiburg, sowie in den Gewächshäusern der
Hartmeyers in Weil am Rhein, wurden in Zusammenarbeit mit der Universität auf
Video aufgezeichnet und in einem Dokumentarfilm („Das Katapult der Diva“, 23
Minuten) zusammengefasst. Dieser ist als DVD/Blu-Ray erhältlich und auf YouTube
in HD frei zugänglich: http://www.youtube.com/watch?v=Zzi3XDQs-i0
Für eine kurze Demonstration der Funktion der Katapult-Leimfalle gibt es inzwischen auch ein frei zugängliches 2½-minütiges Video auf YouTube, ebenfalls in HD:
http://www.youtube.com/watch?v=eFShLcxNswk
Der Originalartikel „Catapulting tentacles in a sticky carnivorous plant” (Simon Poppinga, Siegfried R. H. Hartmeyer, Robin Seidel, Tom Masselter, Irmgard Hartmeyer, Thomas Speck; 2012) ist im Internet bei PloS ONE inklusive der dazugehörigen Belegvideos frei zugänglich:
http://dx.plos.org/10.1371/journal.pone.0045735
Eines der Belegvideos mit mehreren Fangsequenzen der Katapult-Leimfalle wurde bereits zwei Tage nach Erscheinen bei PloS ONE von dem populärwissenschaftlichen Magazin Bild der Wissenschaft zum „Video der Woche“ erkoren: http://www.wissenschaft.de/wissenschaft/news/316230
... und wurde neben etwa 100 wissenschaftlichen Online- und Printmedien weltweit (siehe Link), allein auf dem YouTube-Kanal der Wissenschaftsplattform Quantum Day in wenigen Monaten über 90.000 Mal aufgerufen:
Für eine kurze Demonstration der Funktion der Katapult-Leimfalle gibt es inzwischen auch ein frei zugängliches 2½-minütiges Video auf YouTube, ebenfalls in HD:
http://www.youtube.com/watch?v=eFShLcxNswk
Der Originalartikel „Catapulting tentacles in a sticky carnivorous plant” (Simon Poppinga, Siegfried R. H. Hartmeyer, Robin Seidel, Tom Masselter, Irmgard Hartmeyer, Thomas Speck; 2012) ist im Internet bei PloS ONE inklusive der dazugehörigen Belegvideos frei zugänglich:
http://dx.plos.org/10.1371/journal.pone.0045735
Eines der Belegvideos mit mehreren Fangsequenzen der Katapult-Leimfalle wurde bereits zwei Tage nach Erscheinen bei PloS ONE von dem populärwissenschaftlichen Magazin Bild der Wissenschaft zum „Video der Woche“ erkoren: http://www.wissenschaft.de/wissenschaft/news/316230
... und wurde neben etwa 100 wissenschaftlichen Online- und Printmedien weltweit (siehe Link), allein auf dem YouTube-Kanal der Wissenschaftsplattform Quantum Day in wenigen Monaten über 90.000 Mal aufgerufen:
Literatur
Ashida, J. 1934. Studies on the leaf movement of Aldrovanda vesiculosa L. I. Process and mechanism of the movement. Mem. Coll. Sci. Kyoto Imp. Univ. Ser. B 9: 141-244.
Barthlott, W., Neinhuis, C., Cutler, D., Ditsch, F., Meusel, I., Theisen, I., and Wilhelmi, H. 1998. Classification and terminology of plant epicuticular waxes. Bot. J. Linn. Soc. 126: 237-260.
Barthlott, W., and Hunt, D. 2000. Seed-diversity in Cactaceae subfam. Cactoideae. In: Succulent Plant Research Vol. 5, ed. D. Hundt. David Hunt: Milborne Port.
Bauer, U., Di Giusto, B., Skepper, J., Grafe, T.U., and Federle, W. 2012. With a flick of the lid: a novel trapping mechanism in Nepenthes gracilis pitcher plants. PLoS ONE 7(6): e38951.
Bourke, G., and Nunn, R. 2012. Australian Carnivorous Plants. Redfern Natural History Productions, Poole, Dorset.
Braam, J. 2005. In touch: plant responses to mechanical stimuli. New Phytol. 165: 373-389.
Darwin, C. 1875. Insectivorous Plants. John Murray, London.
Davion, R. 1995. Now you see it - Now you don’t. Flytrap News 8: 17.
Davion, R. 1999. That damned elusive Pimpernel. Flytrap News 13: 10.
Dumais, J., and Forterre, Y. 2012. “Vegetable dynamicks”: the role of water in plant movements. Annu. Rev. Fluid Mech. 44: 453-478.
Erickson, R. 1968. Plants of Prey. Lamb Paterson, Perth.
Fjellberg, A. 1998. The Collembola of Fennoscandia and Denmark Part 1: Poduromorpha. Brill, Leiden.
Forterre, Y., Skotheim, J.M., Dumais, J., and Mahadevan, L. 2005. How the Venus Flytrap snaps. Nature 433: 421-425.
Gibson, T.C., and Waller, D.M. 2009. Evolving Darwin’s ‘most wonderful’ plant: ecological steps to a snap-trap. New Phytol. 183: 575-587.
Hartmeyer, I., and Hartmeyer, S.R.H. 2005. Drosera glanduligera – Der Sonnentau mit “Klapp-Tentakeln”. Das Taublatt 2005/2: 34-38.
Hartmeyer, I., and Hartmeyer, S.R.H. 2006. Drosera: Snap-Tentacles and Runway Lights. DVD documentary, Hunting Veggies, Weil am Rhein. Siehe auch: http://www.youtube.com/watch?v=BY7z15f3Vwg (hochgeladen von ICPStv am 16. April 2010).
Hartmeyer, I., and Hartmeyer, S.R.H. 2010. Snap-tentacles and runway lights. Carnivorous Plant Newsletter 39:101-113.
Hartmeyer, I., and Hartmeyer, S.R.H. 2012a. The Catapult-Flypaper-Trap / Die Katapult-Leimfalle (Das Katapult der Diva). DVD documentary, Hunting Veggies, Weil am Rhein. http://www.youtube.com/watch?v=Zzi3XDQs-i0 (hochgeladen am 26. September 2012 von S.R.H. Hartmeyer.)
Hartmeyer, I., and Hartmeyer, S.R.H. 2012b. Catapult-Flypaper-Trap: Prey-Catching Digest / Katapult-Leimfalle: Beutefang Kurzfilm. Hunting Veggies, Weil am Rhein. http://www.youtube.com/watch?v=eFShLcxNswk (hochgeladen am 13. November 2012 von S.R.H. Hartmeyer.)
Hartmeyer, S.R.H., Hartmeyer, I., Seidel, R., Masselter, T., Speck, T., and Poppinga, S., 2013. Catapults into the deadly trap: The unique prey-capture mechanism of D. glanduligera. Carnivorous Plant Newsletter 42:04-14.
Juniper, B.E., Robins, R.J., and Joel, D.M. 1989. The Carnivorous Plants. Academic Press, London.
Koch, K., Bhushan, B., and Barthlott, W. 2008. Diversity of structure, morphology and wetting of plant surfaces. Soft Matter 4: 1943-1963.
Lehmann, J.G.C. 1844. Nov. Stirp. Pug. 8: 37.
Lloyd, F.E. 1942. The Carnivorous Plants. Chronica Botanica, Waltham.
Lowrie, A. 1989. Carnivorous Plants of Australia Vol. 2. University of Western Australia Press, Perth.
McPherson, S. 2008. Glistening Carnivores - The Sticky-leaved Insect-Eating Plants. Redfern Natural History Productions, Poole, Dorset.
Poppinga, S., and Joyeux, M. 2011. Different mechanics of snap-trapping in the two closely related carnivorous plants Dionaea muscipula and Aldrovanda vesiculosa. Phys. Rev. E 84: 041928.
Poppinga, S., Hartmeyer, S.R.H., Seidel, R., Masselter, T., Hartmeyer, I., and Speck, T. 2012. Catapulting tentacles in a sticky carnivorous plant. PLoS ONE 7(9): e45735.
Rosenstiel, T.N., Shortlidge, E.E., Melnychenko, A.N., Pankow, J.F., and Eppley, S. 2012. Sex-specific volatile compounds influence microarthropod-mediated fertilization of moss. Nature 489: 431-433.
Rice, B. 2007. Carnivorous plants with hybrid trapping strategies. Carniv. Pl. Newslett. 36: 23-27.
Seine, R., and Barthlott, W. 1993. On the morphology of trichomes and tentacles of Droseraceae Salisb. Beitr. Biol. Pflanzen 67: 345-366.
Skotheim, J.M., and Mahadevan, L. 2005. Physical limits and design principles for plant and fungal movements. Science 308: 1308-1310.
Swaine, M.D., and Beer, T. 1977. Explosive seed dispersal in Hura crepitans L. (Euphorbiaceae). New Phytol. 78: 695-708.
Verbeek, N.A.M., and Boasson, R. 1993. Relationship between types of prey captured and growth form in Drosera in southwestern Australia. Aust. J. Ecol. 18: 203-207.
Vincent, O., Weißkopf, C., Poppinga, S., Masselter, T., Speck, T., Joyeux, M., Quilliet, C., and Marmottant, P. 2011. Ultra-fast underwater suction traps. Proc. R. Soc. B 278: 2909-2914.
Volkov, A.G., Foster, J.C., Ashby, T.A., Walker, R.K., Johnson, J.A., and Markin, V.S. 2010. Mimosa pudica: Electrical and mechanical stimulation of plant movements. Plant Cell Environ. 33: 163-173. 14 Carnivorous Plant Newsletter
Watson, A.P., Matthiessen, J.N., and Springett, B.P. 1982. Arthropod associates and macronutrient status of the red-ink sundew (Drosera erythrorhiza Lindl.). Aust. J. Ecol. 7: 13-22.
Williams, S.E., and Pickard, B.G. 1974. Connections and barriers between cells of Drosera tentacles in relation to their electrophysiology. Planta 116: 1-16.
Williams, S.E. 1976. Comparative sensory physiology of the Droseraceae - The evolution of a plant sensory system. Proc. Am. Philos. Soc. 120: 187-204.
